阿斯利康叫停临床试验 新冠疫苗研发多个药企步入Ⅲ期临床试验阶段
9月9日,针对“阿斯利康已经暂停了新冠疫苗临床试验”一事,阿斯利康中国相关负责人向北京商报记者表示,暂停是确保实验完整性的一项常规操作,公司正在努力加快对这个单一事件的核查,最大程度地减少对研究进程的任何潜在影响。疫情发生以来,国内外药企纷纷开展疫苗研发工作,多个药企步入Ⅲ期临床试验阶段。随着首例Ⅲ期临床试验被搁置,新冠疫苗研发赛道的冲刺进程也开始分化。
阿斯利康叫停临床试验
有消息称,因一名英国的临床试验参与者出现疑似严重的不良反应,阿斯利康主动暂停了新冠疫苗的临床试验,并接受独立委员会审查安全数据。受此消息影响,阿斯利康9月8日盘后一度下跌8%。
作为竞速新冠疫苗研发的企业之一,今年5月,阿斯利康与牛津大学确立合作伙伴关系,在全球开发、生产和供应新冠疫苗AZD1222,并承诺将提供超过20亿剂新冠疫苗。该疫苗曾是研发最快的疫苗。4月,牛津大学宣布新冠疫苗开始进入人体临床试验,一个月后便进入下一个阶段。同时,阿斯利康和牛津大学联合开发的新冠腺病毒载体疫苗为目前全球处于临床Ⅲ期试验阶段的新冠疫苗之一。
对于新冠疫苗暂停临床试验的消息,阿斯利康中国相关负责人向北京商报记者回应称,目前公司对正在进行的牛津大学新冠病毒疫苗全球随机对照组试验,启动了标准的审核流程。公司自愿暂停疫苗接种,以保证独立委员会对该疫苗的安全性数据进行核查。“这是确保我们实验完整性的一项常规操作,当一项试验中有任何潜在、无法解释的疾病发生时所采取的必要步骤。在大型临床试验中,偶然会发生这种情况,但我们必须对此进行仔细的独立检查。”阿斯利康中国相关负责人表示。
受到上述消息影响的还有国内企业康泰生物。今年8月,康泰生物与阿斯利康达成新冠疫苗中国内地独家授权合作。昨日开盘康泰生物股价大跳水,下跌16.57%。对于后续合作事宜等问题,北京商报记者联系了康泰生物,但截至发稿未收到回复。
多家企业进入冲刺期
一般来说,疫苗的研发过程分为临床前研究(疫苗原理设计与小剂量制备、动物实验等)、临床试验申报及临床试验(Ⅰ、Ⅱ、Ⅲ期)。在疫苗安全性、有效性得到验证后,经管理部门审批,相关企业可拿到生产批件,进行疫苗规模化生产,投入使用。介于临床与生产之间的一步,Ⅲ期临床试验的重要性不言而喻。
在后来者的追赶下,阿斯利康或将失去先发优势。今年7月,美国药企Moderna和辉瑞分别宣布,旗下新冠病毒疫苗启动Ⅲ期临床试验,并将在美国分别招募3万名志愿者。9月,康希诺生物宣布公司开始与俄罗斯制药公司NPO Petrovax Pharm,LLC合作开展新冠疫苗Ⅲ期临床试验。
新冠疫苗Ⅲ期临床试验成为各大疫苗研发企业的冲刺阶段。世卫组织首席科学家苏米娅·斯瓦米纳坦日前公开表示,全球已有超过30种新冠疫苗进入临床试验阶段,其中有9种新冠疫苗处于Ⅲ期临床试验阶段。
对于此次研发暂停对公司的影响,阿斯利康相关负责人告诉北京商报记者,“我们正在努力加快对这个单一事件的核查,最大程度地减少对研究进程的任何潜在影响。阿斯利康始终秉承临床试验对参与者的安全承诺,并在实验中遵循最高的行为标准”。
国内企业领跑
阿斯利康的新冠疫苗是第一个在Ⅲ期临床试验中被搁置的疫苗,疫苗研发赛道的冲刺已出现分化。北京商报记者梳理发现,9种进入Ⅲ期临床试验的新冠疫苗中,有3款来自中国,分别是国药集团中国生物旗下的灭活疫苗、科兴控股开发的灭活疫苗以及康希诺生物与陈薇院士团队合作开发的腺病毒载体疫苗。
“我们国家处在整个世界新冠疫苗研发的第一方阵。目前在世卫组织公布的已经进入Ⅲ期临床试验的疫苗当中,我们占了一半以上。这个数据已经非常能够说明问题。”国内一位新冠疫苗研发相关负责人说道。
一家国内新冠疫苗研发企业相关负责人向北京商报记者透露,旗下新冠疫苗Ⅲ期临床实验目前正在有效推进。“Ⅲ期试验结果出来之后,我们的产能会同步跟上,做好随时向民众大规模接种的技术准备,争取无缝对接。”
国内另一家新冠疫苗研发企业的相关负责人表示,Ⅲ期临床在疫苗接种人群和双盲对照人群中来检测疫苗的保护性,疫苗志愿者接种后几乎百分百产生抗体,以及这些抗体能否有效预防不得病或者轻感染率,这些结果都需要在Ⅲ期临床中去检测和研究。目前,公司的Ⅲ期临床研究严格按照国际规范设计,已有数千人入组接种疫苗,预计年底前可以出结果。
值得一提的是,国内企业快的同时也更追求质量。“要想研制疫苗,我们的配套设备必须齐全,且清楚知道自己在干什么。我们始终把质量放在第一位,因为疫苗是用于健康人群的,我们要确保它的安全性、免疫原性、及功效。安全永远是第一位的。同时,中国拥有一整套疫苗研发系统,确保了公司的科研人员能够与许多合作者同时进行动物试验。”上述新冠疫苗研发企业相关负责人说道。
标签: 阿斯利康叫停临床试验
-
 多家银行在个人碳账户方面进行尝试 以零售业务作为主要突破口 个人碳积分达到一定数量,可以用于兑换权益、申请绿色贷款——通过布局个人碳账户,不少银行的零售业务开始将触角伸入对公业务为主的绿...
多家银行在个人碳账户方面进行尝试 以零售业务作为主要突破口 个人碳积分达到一定数量,可以用于兑换权益、申请绿色贷款——通过布局个人碳账户,不少银行的零售业务开始将触角伸入对公业务为主的绿... -
 个人养老金制度出台 切实保障养老金投资运作安全规范 国务院办公厅近日印发《关于推动个人养老金发展的意见》。在中国境内参加城镇职工基本养老保险或者城乡居民基本养老保险的劳动者,可以参加
个人养老金制度出台 切实保障养老金投资运作安全规范 国务院办公厅近日印发《关于推动个人养老金发展的意见》。在中国境内参加城镇职工基本养老保险或者城乡居民基本养老保险的劳动者,可以参加 -
 吉林省畜牧局多措并举 加快推动畜牧企业复工复产 4月25日,记者从吉林省召开的新闻发布会获悉,畜产品是菜篮子的重要组成部分,为降低新冠肺炎疫情对全省畜牧业的影响,省畜牧局多措并举,
吉林省畜牧局多措并举 加快推动畜牧企业复工复产 4月25日,记者从吉林省召开的新闻发布会获悉,畜产品是菜篮子的重要组成部分,为降低新冠肺炎疫情对全省畜牧业的影响,省畜牧局多措并举, -
 交通运输部举行新闻发布会 保持经济运行在合理区间 今天(4月26日),交通运输部举行新闻发布会,发布了交通运输一季度经济运行情况。交通运输部综合规划司副司长王松波表示,总的来看,一季度
交通运输部举行新闻发布会 保持经济运行在合理区间 今天(4月26日),交通运输部举行新闻发布会,发布了交通运输一季度经济运行情况。交通运输部综合规划司副司长王松波表示,总的来看,一季度 -
 学前教育资源结构发生格局性变化 幼儿园“小学化”治理成效显著 教育部今天举行新闻发布会,介绍党的十八大以来,我国学前教育发展成就。人生百年,立于幼学。十八大以来,我国学前教育以构建广覆盖、保基
学前教育资源结构发生格局性变化 幼儿园“小学化”治理成效显著 教育部今天举行新闻发布会,介绍党的十八大以来,我国学前教育发展成就。人生百年,立于幼学。十八大以来,我国学前教育以构建广覆盖、保基 -
 多数省份一季度经济运行平稳开局 江西增速领跑 总体来看,大多数省份一季度经济运行都实现了平稳开局,但3月以来疫情的多发局面对经济的冲击加大,成为当下挑战。截至发稿,除了辽宁、吉
多数省份一季度经济运行平稳开局 江西增速领跑 总体来看,大多数省份一季度经济运行都实现了平稳开局,但3月以来疫情的多发局面对经济的冲击加大,成为当下挑战。截至发稿,除了辽宁、吉
-
 上海保供有一条“助老通道”,20天为2万老人送达生活物资 疫情期间,物流运力紧张,保供压力大。而面对老年人这一特殊群体,他们不擅长使用手机网购,有些高龄老人长期住在养老院,需要稳定的食品营养补
上海保供有一条“助老通道”,20天为2万老人送达生活物资 疫情期间,物流运力紧张,保供压力大。而面对老年人这一特殊群体,他们不擅长使用手机网购,有些高龄老人长期住在养老院,需要稳定的食品营养补 - 首个通过GCP功效验证的冲牙器品牌!倍至推动口腔护理行业走进专业化时代 从1922年中国第一支牙膏——三星牙膏诞生,开启本土牙膏业的发展,到如今各式各样的牙膏、漱口水、口腔喷雾、牙贴、口腔爆珠等产品百花...
-
 美丽岸,西雅图现房海景公寓,享尽太平洋艾略特湾之美 美亚置业西雅图海景现房公寓,THE EMERALD 美丽岸,享尽太平洋艾略特湾之美就像西雅图市中心天际线上的一颗宝石,高达40层的西雅图现房海
美丽岸,西雅图现房海景公寓,享尽太平洋艾略特湾之美 美亚置业西雅图海景现房公寓,THE EMERALD 美丽岸,享尽太平洋艾略特湾之美就像西雅图市中心天际线上的一颗宝石,高达40层的西雅图现房海 -
 知名数字资产交易平台8V与Onramper达成合作,强强赋能OTC业务 近日,知名元宇宙生态数字资产交易平台8V隆重宣布与全球领先的OTC服务商Onramper达成战略合作,完了技术对接并正式上线OTC业务。此次合作带来
知名数字资产交易平台8V与Onramper达成合作,强强赋能OTC业务 近日,知名元宇宙生态数字资产交易平台8V隆重宣布与全球领先的OTC服务商Onramper达成战略合作,完了技术对接并正式上线OTC业务。此次合作带来 -
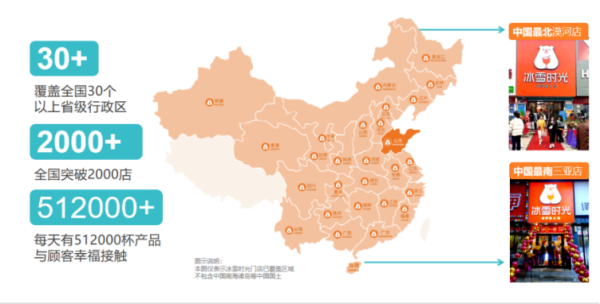 奶茶行业品牌多、竞争大 冰雪时光靠什么赢得掌声? 随着头部品牌的下沉,新式茶饮行业竞争愈发激烈。为了抢占更多市场份额,各大高端茶饮品牌不断拓宽价格带,纷纷推出平价系列产品。即便如此
奶茶行业品牌多、竞争大 冰雪时光靠什么赢得掌声? 随着头部品牌的下沉,新式茶饮行业竞争愈发激烈。为了抢占更多市场份额,各大高端茶饮品牌不断拓宽价格带,纷纷推出平价系列产品。即便如此 -
 原料新鲜 用料扎实 冰雪时光稳扎茶饮下沉市场 近些年来,随着人们生活水平的提高,美团、饿了么等外卖平台盛行,新式茶饮行业迎来快速发展。数据显示,我国在业 存续奶茶相关企业已经达
原料新鲜 用料扎实 冰雪时光稳扎茶饮下沉市场 近些年来,随着人们生活水平的提高,美团、饿了么等外卖平台盛行,新式茶饮行业迎来快速发展。数据显示,我国在业 存续奶茶相关企业已经达 - 住建部科技示范“立体园林绿色建筑”健康中国创意城市在京签约 视日前,住建部科技项目立体园林绿色建筑与健康中国创意城市示范工程合作签约仪式在住建部科技与产业化发展中心举行。住建部科技与产业化发
-
 洪森总理会见太子集团董事长陈志 昨日,洪森总理在和平大厦会见太子集团控股陈志公爵率领的从事矿业、房地产、贸易,物流和证券的投资企业代表。此次访问还反映了陈志公爵和
洪森总理会见太子集团董事长陈志 昨日,洪森总理在和平大厦会见太子集团控股陈志公爵率领的从事矿业、房地产、贸易,物流和证券的投资企业代表。此次访问还反映了陈志公爵和 - 蜜雪冰城:攻守结合 知产保护走在前 你爱我呀我爱你,蜜雪冰城甜蜜蜜……这首歌传遍大街小巷。气温升高,来杯蜜雪冰城的柠檬水,再惬意不过。近年来,蜜雪冰城深耕下沉市场...
-
 岚图FREE实力登顶 东风公司斩获中央广播电视总台·2021中国汽车风云盛典四项大奖 4月26日,由中央广播电视总台主办、总台财经节目中心特别策划的中央广播电视总台·2021中国汽车风云盛典落下帷幕。凭借过硬实力,东风汽车
岚图FREE实力登顶 东风公司斩获中央广播电视总台·2021中国汽车风云盛典四项大奖 4月26日,由中央广播电视总台主办、总台财经节目中心特别策划的中央广播电视总台·2021中国汽车风云盛典落下帷幕。凭借过硬实力,东风汽车 -
 广州加拿达外国语学校——“双出口”给孩子更多选择 很多家长在选择学校时,都有一个需求,他们希望孩子有一个双出口,在高中阶段升学时,既可以走国内升学之路,也可以走国际教育之路。双出口留给
广州加拿达外国语学校——“双出口”给孩子更多选择 很多家长在选择学校时,都有一个需求,他们希望孩子有一个双出口,在高中阶段升学时,既可以走国内升学之路,也可以走国际教育之路。双出口留给 -
 INOT1发行新专辑《冲天之志》NUMBER K COMPANY参与制作 最近INOT1用中文和英文发行了包含主打歌一杯火焰在内的新专辑《冲天之志》, 受到广大粉丝的热烈欢迎。据悉,参与制作INTO1出道专辑的NUMBE
INOT1发行新专辑《冲天之志》NUMBER K COMPANY参与制作 最近INOT1用中文和英文发行了包含主打歌一杯火焰在内的新专辑《冲天之志》, 受到广大粉丝的热烈欢迎。据悉,参与制作INTO1出道专辑的NUMBE - 盈康生命财报暗藏转机,聪明资金增持 4月25日,盈康生命科技股份有限公司(简称:盈康生命,代码:300143 SZ)发布业绩预告,预计2021年营业收入实现110,000万元,重组前口径同
-
 外汇天眼:外汇交易中出金有问题,如何正确维权? 关注外汇天眼的投资者一定经常到天眼君发布《成功到账》系列的文章,在这些文章中遭遇了外汇出金问题的投资者都如愿拿到了自己被拖延的资金
外汇天眼:外汇交易中出金有问题,如何正确维权? 关注外汇天眼的投资者一定经常到天眼君发布《成功到账》系列的文章,在这些文章中遭遇了外汇出金问题的投资者都如愿拿到了自己被拖延的资金 -
 弥玥泉喷雾丨妈生好皮的底妆秘诀,终于跟化妆师学会了 阳光正好,微风不燥,一颗疯狂想外出的心早就按捺不住了,这样的好天气,不化个美美的妆、约个三五好友赏花看景,简直就是辜负好时光呀!不过,对
弥玥泉喷雾丨妈生好皮的底妆秘诀,终于跟化妆师学会了 阳光正好,微风不燥,一颗疯狂想外出的心早就按捺不住了,这样的好天气,不化个美美的妆、约个三五好友赏花看景,简直就是辜负好时光呀!不过,对 -
 2022广州从化区幼儿园报名 小区从化户籍业主子女报名时间公布 ➤小区配套幼儿园从化户籍业主子女报名时间:4月28日至30日上午9:00-12:00,下午14:30-17:30注:小区从化户籍业主子女报名时间,符合条件的
2022广州从化区幼儿园报名 小区从化户籍业主子女报名时间公布 ➤小区配套幼儿园从化户籍业主子女报名时间:4月28日至30日上午9:00-12:00,下午14:30-17:30注:小区从化户籍业主子女报名时间,符合条件的 -
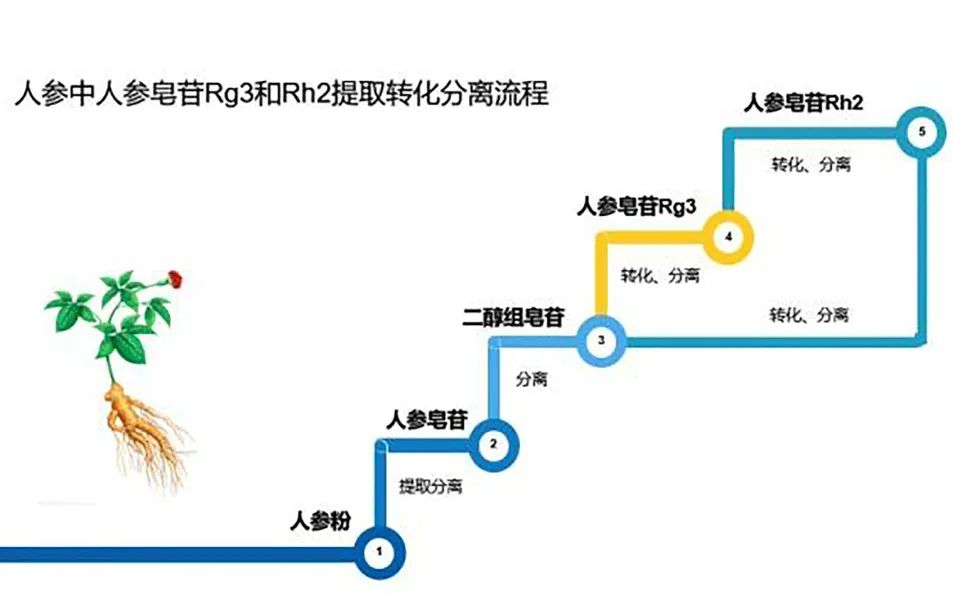 安普胶囊人参皂苷产品,抗癌修复、增强免疫的天然护命素! 人参自古即有「百草之王」之称,居中国四大补品之首,一直以来都备受推崇。其主要有大补元气,安神益智、复脉固脱,补脾益肺,生津止渴等来
安普胶囊人参皂苷产品,抗癌修复、增强免疫的天然护命素! 人参自古即有「百草之王」之称,居中国四大补品之首,一直以来都备受推崇。其主要有大补元气,安神益智、复脉固脱,补脾益肺,生津止渴等来 -
 天津知识产权保护体系进一步完善 高效益加快知识产权价值实现 市政府新闻办昨天召开新闻发布会,发布《2021年天津市知识产权发展状况白皮书》和《2021年天津市知识产权保护状况白皮书》。记者从发布会上
天津知识产权保护体系进一步完善 高效益加快知识产权价值实现 市政府新闻办昨天召开新闻发布会,发布《2021年天津市知识产权发展状况白皮书》和《2021年天津市知识产权保护状况白皮书》。记者从发布会上 -
 从安全相识到牵手奔现 爱聊阐释了线上社交的四个阶段 近日,由于疫情的原因,许多小情侣见不到面,被迫开启了网恋模式,也正因如此,关于线上交友的问题,也成为了我们茶余饭后的谈资。一位在爱聊APP
从安全相识到牵手奔现 爱聊阐释了线上社交的四个阶段 近日,由于疫情的原因,许多小情侣见不到面,被迫开启了网恋模式,也正因如此,关于线上交友的问题,也成为了我们茶余饭后的谈资。一位在爱聊APP -
 下调金融机构外汇存款准备金率 提升金融机构外汇资金运用能力 据央行网站4月25日晚间消息,为提升金融机构外汇资金运用能力,中国人民银行决定,自2022年5月15日起,下调金融机构外汇存款准备金率1个百
下调金融机构外汇存款准备金率 提升金融机构外汇资金运用能力 据央行网站4月25日晚间消息,为提升金融机构外汇资金运用能力,中国人民银行决定,自2022年5月15日起,下调金融机构外汇存款准备金率1个百 -
 蝶适-DISC,让近视青少年拥有光明未来 近日,越发受到关注的青少年近视防控问题有了最新的成果研究,蝶适-DISC的出现,大放光彩,被有些消费者称之为划时代的新突破,给万千青少
蝶适-DISC,让近视青少年拥有光明未来 近日,越发受到关注的青少年近视防控问题有了最新的成果研究,蝶适-DISC的出现,大放光彩,被有些消费者称之为划时代的新突破,给万千青少 -
 《现在就告白5》,爱情和爱好不能并存吗? 她喜欢宠物,于是养了一屋子爬宠;他因少时被蛇咬过,所以一直对于爬宠敬而远之。有一天,她与他相遇。在一起半年后,她主动告知关于爬宠的
《现在就告白5》,爱情和爱好不能并存吗? 她喜欢宠物,于是养了一屋子爬宠;他因少时被蛇咬过,所以一直对于爬宠敬而远之。有一天,她与他相遇。在一起半年后,她主动告知关于爬宠的 -
 钢铁行业受供给约束成本持续上升 提高经济效益难度增大 今年一季度,中国钢铁行业受供给约束、需求收缩、成本上升等因素影响,营收利润出现下降。4月25日,中国钢铁工业协会举行2022年一季度信息
钢铁行业受供给约束成本持续上升 提高经济效益难度增大 今年一季度,中国钢铁行业受供给约束、需求收缩、成本上升等因素影响,营收利润出现下降。4月25日,中国钢铁工业协会举行2022年一季度信息 -
 完美世界高开高走 公司游戏研发升级转型已见成效 4月26日早盘,完美世界高开高走。截至发稿已封死涨停,涨停板封单接近25万手之巨。消息面,4月25日晚间完美世界发布2021年年报及2022年第一
完美世界高开高走 公司游戏研发升级转型已见成效 4月26日早盘,完美世界高开高走。截至发稿已封死涨停,涨停板封单接近25万手之巨。消息面,4月25日晚间完美世界发布2021年年报及2022年第一 -
 同花顺早盘大幅走低 一季度市场行情波动较大 4月26日,同花顺早盘大幅走低,一度跌超13%,报76 3元,跌超10%。4月25日,同花顺披露2022年第一季度报告,公司实现营业收入5 15亿元,同比
同花顺早盘大幅走低 一季度市场行情波动较大 4月26日,同花顺早盘大幅走低,一度跌超13%,报76 3元,跌超10%。4月25日,同花顺披露2022年第一季度报告,公司实现营业收入5 15亿元,同比 -
 药明康德强势反弹 规模效应得以进一步显现 4月26日早盘,药明康德强势反弹。截至发稿报101 56元,涨3 87%,已将昨日跌幅全部收回。消息面,4月25日晚间,药明康德披露一季报,公司实
药明康德强势反弹 规模效应得以进一步显现 4月26日早盘,药明康德强势反弹。截至发稿报101 56元,涨3 87%,已将昨日跌幅全部收回。消息面,4月25日晚间,药明康德披露一季报,公司实 -
 4月以来各大指数继续震荡下跌 医药龙头股恒瑞医药开盘即暴跌 今日(26日)早盘,A股三大股指集体高开,沪指涨0 07%,深证成指涨0 22%,创业板涨0 17%。4月25日,上证指数跌破3000点,96%以上个股下跌。在
4月以来各大指数继续震荡下跌 医药龙头股恒瑞医药开盘即暴跌 今日(26日)早盘,A股三大股指集体高开,沪指涨0 07%,深证成指涨0 22%,创业板涨0 17%。4月25日,上证指数跌破3000点,96%以上个股下跌。在 - 远东股份:子公司圣达电气失控不再并表,原总经理李民被刑事立案 远东股份(3 580, -0 19, -5 04%)昨晚公告,控股子公司圣达电气有限公司(以下简称圣达电气)原法定代表人、董事、总经理(已解除劳动关系)李
-
 华润万家以变化的姿态拥抱“可持续” 在第53个世界地球日到来时,始终致力于引领消费升级,共创美好生活的华润万家,将可持续理念融入到日常经营管理中,坚持探讨更多绿色行动,
华润万家以变化的姿态拥抱“可持续” 在第53个世界地球日到来时,始终致力于引领消费升级,共创美好生活的华润万家,将可持续理念融入到日常经营管理中,坚持探讨更多绿色行动, -
 沪指跌破3000点关口后再次跌破2900点 市场担忧情绪再起 4月25日,沪指跌破3000点关口,4月26日开盘,再次跌破2900点,市场担忧情绪再起。作为资本市场的重要长期投资者及压舱石,险资对未来市场怎
沪指跌破3000点关口后再次跌破2900点 市场担忧情绪再起 4月25日,沪指跌破3000点关口,4月26日开盘,再次跌破2900点,市场担忧情绪再起。作为资本市场的重要长期投资者及压舱石,险资对未来市场怎 -
 A股大盘跌破2900点 市场担忧情绪进一步升温 每次跌破3000点之后抄底的,之后基本都是赢家。看着上证指数一度跌破2900点后反弹,深圳一位私募人士向第一财经记者表示。虽然上证指数多年
A股大盘跌破2900点 市场担忧情绪进一步升温 每次跌破3000点之后抄底的,之后基本都是赢家。看着上证指数一度跌破2900点后反弹,深圳一位私募人士向第一财经记者表示。虽然上证指数多年 -
 A股全线飘绿三大股指均收跌逾5% 沪指失守3000点 4月25日,A股全线飘绿,三大股指均收跌逾5%,其中沪指失守3000点,最低下探至2928 51点,系自2020年6月19日以来的指数新低。深证成指收跌6
A股全线飘绿三大股指均收跌逾5% 沪指失守3000点 4月25日,A股全线飘绿,三大股指均收跌逾5%,其中沪指失守3000点,最低下探至2928 51点,系自2020年6月19日以来的指数新低。深证成指收跌6 -
 多个奢侈品牌宣布提价 奢侈品本身不具备真正的投资价值 近期,多个奢侈品牌宣布提价,奢侈品市场涨声一片。在奢侈品保值增值预期下,一些消费者受到刺激,动起了投资的念头。分析人士提醒,奢侈品
多个奢侈品牌宣布提价 奢侈品本身不具备真正的投资价值 近期,多个奢侈品牌宣布提价,奢侈品市场涨声一片。在奢侈品保值增值预期下,一些消费者受到刺激,动起了投资的念头。分析人士提醒,奢侈品 -
 十几元钱的奶茶,冰雪时光是怎么做到好喝又高级的? 随着消费的不断升级,近几年新式茶饮店也如雨后春笋般的崛起,街边随处可见各种品牌的茶饮店铺。消费者也从最开始的单纯追求口感,到现在健
十几元钱的奶茶,冰雪时光是怎么做到好喝又高级的? 随着消费的不断升级,近几年新式茶饮店也如雨后春笋般的崛起,街边随处可见各种品牌的茶饮店铺。消费者也从最开始的单纯追求口感,到现在健 -
 北京丰台全力保障居民“菜篮子” 新发地蔬菜交易市场有序进行 为做好保供稳价工作,北京市丰台区今天启动点对点补货机制,第一时间发动新发地、岳各庄两大批发市场,做好货源组织工作,协调加快保供车辆
北京丰台全力保障居民“菜篮子” 新发地蔬菜交易市场有序进行 为做好保供稳价工作,北京市丰台区今天启动点对点补货机制,第一时间发动新发地、岳各庄两大批发市场,做好货源组织工作,协调加快保供车辆 -
 伊施以勒签约“创世纪-米开朗基罗”进军中国数字藏品市场 作为元宇宙的重要应用方式,数字藏品市场短期内在我国爆发式增长,成为文旅行业广泛关注的焦点。作为国际顶级IP的创世纪-米开朗基罗,近日
伊施以勒签约“创世纪-米开朗基罗”进军中国数字藏品市场 作为元宇宙的重要应用方式,数字藏品市场短期内在我国爆发式增长,成为文旅行业广泛关注的焦点。作为国际顶级IP的创世纪-米开朗基罗,近日 -
 “土货”成为抢手“网货” 秀山县大力发展农村电商产业 长久以来,物流产品人才是制约农村电商发展的三大难题。重庆秀山县以构建城乡双向物流、打造电商产业扶贫基地、开展电商培训等手段破解难题
“土货”成为抢手“网货” 秀山县大力发展农村电商产业 长久以来,物流产品人才是制约农村电商发展的三大难题。重庆秀山县以构建城乡双向物流、打造电商产业扶贫基地、开展电商培训等手段破解难题 -
 河南发放转向资金补贴 升级赏花春游产业链 五一将至,春夏之交,全国许多地方都处于赏花高峰期,踏青赏花的照片遍布微信朋友圈。加之受疫情影响,近郊游火热,自然更是带动了赏花经济
河南发放转向资金补贴 升级赏花春游产业链 五一将至,春夏之交,全国许多地方都处于赏花高峰期,踏青赏花的照片遍布微信朋友圈。加之受疫情影响,近郊游火热,自然更是带动了赏花经济 -
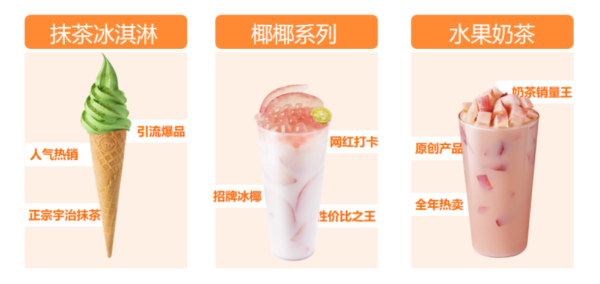 餐饮寒冬季,冰雪时光为何掀起开店热潮? 2020年以来,疫情的阴影一直笼罩着全球经济的各行各业,中小微企业受到了极大的冲击,餐饮业更是迎来了非常艰难的时刻。以奶茶行业为例,无
餐饮寒冬季,冰雪时光为何掀起开店热潮? 2020年以来,疫情的阴影一直笼罩着全球经济的各行各业,中小微企业受到了极大的冲击,餐饮业更是迎来了非常艰难的时刻。以奶茶行业为例,无 -
 我国消费者权益保护工作面临挑战 加大消费者权益保护力度 中国消费者协会近日在北京发布《中国消费者权益保护状况年度报告(2021)》(以下简称《报告》)。这是中消协首次以年度报告形式,全面梳理我国
我国消费者权益保护工作面临挑战 加大消费者权益保护力度 中国消费者协会近日在北京发布《中国消费者权益保护状况年度报告(2021)》(以下简称《报告》)。这是中消协首次以年度报告形式,全面梳理我国 -
 多家银行在个人碳账户方面进行尝试 以零售业务作为主要突破口 个人碳积分达到一定数量,可以用于兑换权益、申请绿色贷款——通过布局个人碳账户,不少银行的零售业务开始将触角伸入对公业务为主的绿...
多家银行在个人碳账户方面进行尝试 以零售业务作为主要突破口 个人碳积分达到一定数量,可以用于兑换权益、申请绿色贷款——通过布局个人碳账户,不少银行的零售业务开始将触角伸入对公业务为主的绿... -
 个人养老金制度出台 切实保障养老金投资运作安全规范 国务院办公厅近日印发《关于推动个人养老金发展的意见》。在中国境内参加城镇职工基本养老保险或者城乡居民基本养老保险的劳动者,可以参加
个人养老金制度出台 切实保障养老金投资运作安全规范 国务院办公厅近日印发《关于推动个人养老金发展的意见》。在中国境内参加城镇职工基本养老保险或者城乡居民基本养老保险的劳动者,可以参加 -
 吉林省畜牧局多措并举 加快推动畜牧企业复工复产 4月25日,记者从吉林省召开的新闻发布会获悉,畜产品是菜篮子的重要组成部分,为降低新冠肺炎疫情对全省畜牧业的影响,省畜牧局多措并举,
吉林省畜牧局多措并举 加快推动畜牧企业复工复产 4月25日,记者从吉林省召开的新闻发布会获悉,畜产品是菜篮子的重要组成部分,为降低新冠肺炎疫情对全省畜牧业的影响,省畜牧局多措并举, -
 交通运输部举行新闻发布会 保持经济运行在合理区间 今天(4月26日),交通运输部举行新闻发布会,发布了交通运输一季度经济运行情况。交通运输部综合规划司副司长王松波表示,总的来看,一季度
交通运输部举行新闻发布会 保持经济运行在合理区间 今天(4月26日),交通运输部举行新闻发布会,发布了交通运输一季度经济运行情况。交通运输部综合规划司副司长王松波表示,总的来看,一季度 -
 直击第53届卡思曼伯意大利博洛尼亚国际美容展!邀您云端逛展 第53届卡思曼伯意大利博洛尼亚国际美容展在时隔疫情两年后首次线下回归。2022年4月28日-5月2日,在全化妆品领域生产商和零售商的殷切期盼中
直击第53届卡思曼伯意大利博洛尼亚国际美容展!邀您云端逛展 第53届卡思曼伯意大利博洛尼亚国际美容展在时隔疫情两年后首次线下回归。2022年4月28日-5月2日,在全化妆品领域生产商和零售商的殷切期盼中 - 盈康生命发布业绩预告,实控人一致行动人增持彰显信心 4月25日,盈康生命科技股份有限公司(简称:盈康生命,代码:300143 SZ)发布业绩预告,预计2021年营业收入实现100,000万元~110,000万元,
-
 学前教育资源结构发生格局性变化 幼儿园“小学化”治理成效显著 教育部今天举行新闻发布会,介绍党的十八大以来,我国学前教育发展成就。人生百年,立于幼学。十八大以来,我国学前教育以构建广覆盖、保基
学前教育资源结构发生格局性变化 幼儿园“小学化”治理成效显著 教育部今天举行新闻发布会,介绍党的十八大以来,我国学前教育发展成就。人生百年,立于幼学。十八大以来,我国学前教育以构建广覆盖、保基 -
 多数省份一季度经济运行平稳开局 江西增速领跑 总体来看,大多数省份一季度经济运行都实现了平稳开局,但3月以来疫情的多发局面对经济的冲击加大,成为当下挑战。截至发稿,除了辽宁、吉
多数省份一季度经济运行平稳开局 江西增速领跑 总体来看,大多数省份一季度经济运行都实现了平稳开局,但3月以来疫情的多发局面对经济的冲击加大,成为当下挑战。截至发稿,除了辽宁、吉 -
 阿卡索优享1v1课程广受赞誉 阿卡索作为一家在英语教育行业拥有10年+教学经验的机构,一直深受广大学习者的喜爱。它以严格筛选的外教、多元化的课程内容、进阶式上升的
阿卡索优享1v1课程广受赞誉 阿卡索作为一家在英语教育行业拥有10年+教学经验的机构,一直深受广大学习者的喜爱。它以严格筛选的外教、多元化的课程内容、进阶式上升的 -
 世界知识产权日 | 天威诚信助力专利证书全面电子化,激发产业创新发展活力 今天,是第22个世界知识产权日。世界知识产权日设立的目的是在世界范围内树立尊重知识、崇尚科学和保护知识产权的意识,营造鼓励知识创新和
世界知识产权日 | 天威诚信助力专利证书全面电子化,激发产业创新发展活力 今天,是第22个世界知识产权日。世界知识产权日设立的目的是在世界范围内树立尊重知识、崇尚科学和保护知识产权的意识,营造鼓励知识创新和
热门资讯
-
 知名数字资产交易平台8V与Onramper达成合作,强强赋能OTC业务 近日,知名元宇宙生态数字资产交易...
知名数字资产交易平台8V与Onramper达成合作,强强赋能OTC业务 近日,知名元宇宙生态数字资产交易... -
 外汇天眼:外汇交易中出金有问题,如何正确维权? 关注外汇天眼的投资者一定经常到天...
外汇天眼:外汇交易中出金有问题,如何正确维权? 关注外汇天眼的投资者一定经常到天... -
 健康饮食需求激增!DROODS道得富以健康食品助力改善国民健康水平 自健康中国战略实施以来,人民群众...
健康饮食需求激增!DROODS道得富以健康食品助力改善国民健康水平 自健康中国战略实施以来,人民群众... -
 常州京城皮肤病医院樊战军:为什么很多皮肤病夜间觉得瘙痒 有皮肤病的友友们有没有觉得很疑惑...
常州京城皮肤病医院樊战军:为什么很多皮肤病夜间觉得瘙痒 有皮肤病的友友们有没有觉得很疑惑...
观察
图片新闻
-
 山东开展药品经营专项检查 及时排查和化解风险隐患 日前,山东省药品监督管理局印发《...
山东开展药品经营专项检查 及时排查和化解风险隐患 日前,山东省药品监督管理局印发《... -
 国家外汇管理局深化外汇领域改革开放 促进跨境贸易投资便利化 中国人民银行、银保监会、证监会、...
国家外汇管理局深化外汇领域改革开放 促进跨境贸易投资便利化 中国人民银行、银保监会、证监会、... -
 全球气候变化问题日益突出 零碳咖啡见证绿色办会 柜台前排起长龙,咖啡师两手并用,...
全球气候变化问题日益突出 零碳咖啡见证绿色办会 柜台前排起长龙,咖啡师两手并用,... -
 “酸菜味”方便面回归超市货架 方便面市场空间被挤压 近日,多家企业的酸菜味方便面纷纷...
“酸菜味”方便面回归超市货架 方便面市场空间被挤压 近日,多家企业的酸菜味方便面纷纷...
精彩新闻
-
 健康饮食需求激增!DROODS道得富以健康食品助力改善国民健康水平 自健康中国战略实施以来,人民群众...
健康饮食需求激增!DROODS道得富以健康食品助力改善国民健康水平 自健康中国战略实施以来,人民群众... -
 助力疫情期间“不断奶” 达能纽迪希亚守护上海儿童营养 “不掉队” 四月以来,达能纽迪希亚生命早期营...
助力疫情期间“不断奶” 达能纽迪希亚守护上海儿童营养 “不掉队” 四月以来,达能纽迪希亚生命早期营... - 盈康生命发布2021年业绩预告,预计营收首超10亿 4月25日,盈康生命科技股份有限公...
-
 草莓、荔枝、桃花……近100种新口味低度酒在天猫超市开卖 初夏将至,口味新、包装潮的低度酒...
草莓、荔枝、桃花……近100种新口味低度酒在天猫超市开卖 初夏将至,口味新、包装潮的低度酒... -
 戴口罩也能人脸识别 亚略特智能防疫设备落地医院防疫一线 前不久,苹果发布了iOS 15 4,新...
戴口罩也能人脸识别 亚略特智能防疫设备落地医院防疫一线 前不久,苹果发布了iOS 15 4,新... -
 轨道插座是智商税吗?安全好用的MEYEO美沿移动轨道插座,PICK一下! 轨道插座是不是智商税?轨道插座是...
轨道插座是智商税吗?安全好用的MEYEO美沿移动轨道插座,PICK一下! 轨道插座是不是智商税?轨道插座是... -
 电商江湖千帆竞发,卷尾科技助力企业直播带货 短视频应用的兴起,直播成为了当下...
电商江湖千帆竞发,卷尾科技助力企业直播带货 短视频应用的兴起,直播成为了当下... -
 菜鸟正展开街道攻坚战 天猫超市上海配送逐步恢复 上海快递物流恢复情况如何?记者从...
菜鸟正展开街道攻坚战 天猫超市上海配送逐步恢复 上海快递物流恢复情况如何?记者从... -
 Blueglass 自然探索骑行,成为更好的自己 不要忘记去体验伟大不要忘记去致敬...
Blueglass 自然探索骑行,成为更好的自己 不要忘记去体验伟大不要忘记去致敬... -
 2022年五一假期铁路客票预售期是多长时间 自2022年4月7日起,铁路客票预售期...
2022年五一假期铁路客票预售期是多长时间 自2022年4月7日起,铁路客票预售期... -
 5月1日起取消初中毕业后普职分流 让更多人可以升入普通高中 新修订的《中华人民共和国职业教育...
5月1日起取消初中毕业后普职分流 让更多人可以升入普通高中 新修订的《中华人民共和国职业教育... -
 2022年广州从化区幼儿园招生 电脑摇号的比例为招生学位数的90% 非小区配套幼儿园:从化区幼儿园、...
2022年广州从化区幼儿园招生 电脑摇号的比例为招生学位数的90% 非小区配套幼儿园:从化区幼儿园、... -
 常州京城皮肤病医院樊战军:为什么很多皮肤病夜间觉得瘙痒 有皮肤病的友友们有没有觉得很疑惑...
常州京城皮肤病医院樊战军:为什么很多皮肤病夜间觉得瘙痒 有皮肤病的友友们有没有觉得很疑惑... -
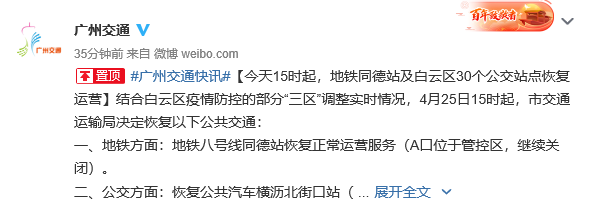 广州地铁8号线同德站B、C口恢复通行 A口位于管控区继续关闭 图源:广州交通微博结合白云区疫情...
广州地铁8号线同德站B、C口恢复通行 A口位于管控区继续关闭 图源:广州交通微博结合白云区疫情... -
 4月25日广州白云区公交站点线路情况一览 结合白云区疫情防控的部分三区调整...
4月25日广州白云区公交站点线路情况一览 结合白云区疫情防控的部分三区调整... -
 新技术“膨体聚四氟乙烯泪沟矫正”在《中国美容医学》成功发表 《中国美容医学》4月2日消息,中日...
新技术“膨体聚四氟乙烯泪沟矫正”在《中国美容医学》成功发表 《中国美容医学》4月2日消息,中日... -
 “膨体聚四氟乙烯泪沟矫正”在《中国美容医学》成功发表 近日,由中日友好医院整形外科副主...
“膨体聚四氟乙烯泪沟矫正”在《中国美容医学》成功发表 近日,由中日友好医院整形外科副主... -
 元道经纬相机,助力工程现场高效管理 建筑工程的现场管理对于整个工程而...
元道经纬相机,助力工程现场高效管理 建筑工程的现场管理对于整个工程而... -
 动起来!与FITURE魔镜见习教练杨舒予一起变身甜酷女孩 近日,国内知名健身镜品牌FITURE魔...
动起来!与FITURE魔镜见习教练杨舒予一起变身甜酷女孩 近日,国内知名健身镜品牌FITURE魔... -
 “书”送甜蜜力量 蜜雪点亮希望 蜜雪冰城总动员为乡村孩子们捐赠图书 2022年4月23日是第27个世界读书日...
“书”送甜蜜力量 蜜雪点亮希望 蜜雪冰城总动员为乡村孩子们捐赠图书 2022年4月23日是第27个世界读书日... -
 吉林加强蓄水工程管理 确保春灌供水安全 4月24日,记者从本轮吉林省疫情防...
吉林加强蓄水工程管理 确保春灌供水安全 4月24日,记者从本轮吉林省疫情防... -
 山东开展药品经营专项检查 及时排查和化解风险隐患 日前,山东省药品监督管理局印发《...
山东开展药品经营专项检查 及时排查和化解风险隐患 日前,山东省药品监督管理局印发《... -
 国家外汇管理局深化外汇领域改革开放 促进跨境贸易投资便利化 中国人民银行、银保监会、证监会、...
国家外汇管理局深化外汇领域改革开放 促进跨境贸易投资便利化 中国人民银行、银保监会、证监会、... -
 全球气候变化问题日益突出 零碳咖啡见证绿色办会 柜台前排起长龙,咖啡师两手并用,...
全球气候变化问题日益突出 零碳咖啡见证绿色办会 柜台前排起长龙,咖啡师两手并用,... -
 “酸菜味”方便面回归超市货架 方便面市场空间被挤压 近日,多家企业的酸菜味方便面纷纷...
“酸菜味”方便面回归超市货架 方便面市场空间被挤压 近日,多家企业的酸菜味方便面纷纷... -
 人民银行将普惠小微企业贷款延期支持工具转换为支持工具 记者从人民银行广州分行获悉,近日...
人民银行将普惠小微企业贷款延期支持工具转换为支持工具 记者从人民银行广州分行获悉,近日... -
 北京商超通过产地直采调货机制紧急增加货量 保障市场供应稳定 面对突发的疫情,北京各大商超企业...
北京商超通过产地直采调货机制紧急增加货量 保障市场供应稳定 面对突发的疫情,北京各大商超企业... -
 农村“一刻钟”建模 一体化县域商业网络体系升级 北京的便民商业网点建设已从市区延...
农村“一刻钟”建模 一体化县域商业网络体系升级 北京的便民商业网点建设已从市区延... -
 百万医疗险0免赔额产品面世 缓解小额医疗费用无法理赔痛点 几百元的保费、上百万元的保额,百...
百万医疗险0免赔额产品面世 缓解小额医疗费用无法理赔痛点 几百元的保费、上百万元的保额,百... -
 步步高披露2021年业绩预告 净利润同比由盈转亏 4月25日,步步高(002251)一字跌停...
步步高披露2021年业绩预告 净利润同比由盈转亏 4月25日,步步高(002251)一字跌停... -
 资金掮客卷土重来 做起了“过桥”融资的生意 受疫情多地散发影响,部分用户因确...
资金掮客卷土重来 做起了“过桥”融资的生意 受疫情多地散发影响,部分用户因确... -
 辛巴再陷“假货”风波 到底谁才是“正品”? 主播辛巴再陷假货风波,辛巴与涉事...
辛巴再陷“假货”风波 到底谁才是“正品”? 主播辛巴再陷假货风波,辛巴与涉事... -
 自动驾驶是场马拉松 资本明显往头部企业聚集 这块碳是我和团队调研矿山时捡回来...
自动驾驶是场马拉松 资本明显往头部企业聚集 这块碳是我和团队调研矿山时捡回来... -
 潍坊高新区通过工业地产模式建设动力装备国际配套产业园 产业是城市发展的基石,优化其生态...
潍坊高新区通过工业地产模式建设动力装备国际配套产业园 产业是城市发展的基石,优化其生态... -
 国内咖啡豆市场持续火爆 保税仓储业务减少关税成本等资金占用 日前,在办结海关监管通关手续后,...
国内咖啡豆市场持续火爆 保税仓储业务减少关税成本等资金占用 日前,在办结海关监管通关手续后,... -
 辽宁省持续优化口岸营商环境 为市场主体提供通关预期 2022年以来,辽宁省坚决贯彻党中央...
辽宁省持续优化口岸营商环境 为市场主体提供通关预期 2022年以来,辽宁省坚决贯彻党中央... -
 我国冷链物流行业高质量发展 布局建设骨干冷链物流基地 近日,交通运输部、国家铁路局、中...
我国冷链物流行业高质量发展 布局建设骨干冷链物流基地 近日,交通运输部、国家铁路局、中... -
 江苏省依托广交会产业帮扶优势 帮助特色产业对接大市场 走过六十五载的中国第一展,除了作...
江苏省依托广交会产业帮扶优势 帮助特色产业对接大市场 走过六十五载的中国第一展,除了作... -
 邹少雄作词;刘晓勇作曲新歌《龙凤呈祥》上线,谭俊芳唱出婚礼美好瞬间 婚礼是每个人一生中最难忘的时刻之...
邹少雄作词;刘晓勇作曲新歌《龙凤呈祥》上线,谭俊芳唱出婚礼美好瞬间 婚礼是每个人一生中最难忘的时刻之... -
 中国利用外资结构持续优化 高技术制造业吸引外资高速增长 今年1-3月中国吸收外资同比快速增...
中国利用外资结构持续优化 高技术制造业吸引外资高速增长 今年1-3月中国吸收外资同比快速增... -
 云上广交会搭建平台 为境外参展商敲开中国市场的门 西洋牛油糕、阿富汗羊毛手工地毯、...
云上广交会搭建平台 为境外参展商敲开中国市场的门 西洋牛油糕、阿富汗羊毛手工地毯、... -
 市场监管部门在海洋伏季休渔期间组织专项执法行动 为强化海洋伏季休渔期间水产品交易...
市场监管部门在海洋伏季休渔期间组织专项执法行动 为强化海洋伏季休渔期间水产品交易... -
 公众如何防骗识骗? 自觉远离抵制不良低俗文化 在中央办公厅、国务院办公厅印发《...
公众如何防骗识骗? 自觉远离抵制不良低俗文化 在中央办公厅、国务院办公厅印发《... -
 老用户“进货式”买手机壳 根据季节、心情更换手机壳 手机壳正在成为年轻人频繁更换的独...
老用户“进货式”买手机壳 根据季节、心情更换手机壳 手机壳正在成为年轻人频繁更换的独... -
 网络游戏持续加强管控 另类“盲盒”中小学生再次风靡 家住北京市海淀区学院路街道的李华...
网络游戏持续加强管控 另类“盲盒”中小学生再次风靡 家住北京市海淀区学院路街道的李华... -
 平潭一季度经济运行态势良好 打造“保姆式”服务助力项目建设 12个文旅项目集中开工,总投资16 ...
平潭一季度经济运行态势良好 打造“保姆式”服务助力项目建设 12个文旅项目集中开工,总投资16 ... -
 杭州电商平台全力保供 供应链各环节联动反应 对于一下子静下来的社区,日常生活...
杭州电商平台全力保供 供应链各环节联动反应 对于一下子静下来的社区,日常生活... -
 广东预制菜产业高质量发展走在全国前列 企业转型升级忙 广东要吃下万亿元的预制菜市场。3...
广东预制菜产业高质量发展走在全国前列 企业转型升级忙 广东要吃下万亿元的预制菜市场。3... -
 阳光出行司机账号永久下线怎么办?网约车新政开始实施 现今,随着互联网时代的到来,其正...
阳光出行司机账号永久下线怎么办?网约车新政开始实施 现今,随着互联网时代的到来,其正... -
 农产品电商的发展由“数字农业”向“数字农产品”转型 作为我国县域经济发展的新引擎,目...
农产品电商的发展由“数字农业”向“数字农产品”转型 作为我国县域经济发展的新引擎,目...