当前报道:首个国产新冠特效药正式上市:定价1万元以内
 (资料图片仅供参考)
(资料图片仅供参考)
IT之家 7 月 9 日消息,据北京日报报道,7 月 7 日,腾盛博药及其旗下控股公司腾盛华创宣布,其新冠中和抗体安巴韦单抗和罗米司韦单抗联合疗法在中国商业化上市,首批抗体药物已经实现商业放行。该药也是首个获批的国产新冠中和抗体联合疗法药物。
昨天,在新冠中和抗体安巴韦单抗和罗米司韦单抗联合疗法线上商业上市媒体沟通会上,腾盛博药总裁兼首席执行官罗永庆向记者表示,该联合疗法仍对奥密克戎变异株 BA.4、BA.5 有效,并公布了这款药的国内定价:基本上在 1 万人民币以内。
据悉,目前安巴韦单抗和罗米司韦单抗联合疗法的是自主定价。在海外,该药物的商业模式是采取政府采购的模式,比如说在美国,政府采购几百万人份的规模下,每人份的政府采购价格在 1500 到 2000 美元。目前在中国的定价是低于美国的采购价格,基本上在 1 万人民币以内。罗永庆透露,在研发安巴韦单抗和罗米司韦单抗的时候,公司前后投入超过两亿美元以确保研发和商业化的顺利进行。
根据美国国立卫生研究院(NIH)/美国国家过敏和传染病研究所(NIAID)支持的包括 837 例入组门诊患者的 ACTIV-2 研究三期临床试验最终结果显示,与安慰剂相比,安巴韦单抗和罗米司韦单抗联合疗法使临床进展高风险的新冠门诊患者的住院和死亡风险降低 80%,具有统计学显著性。截至 28 天的临床终点,治疗组为零死亡而安慰剂组有 9 例死亡,并且其临床安全性优于安慰剂组。同时,无论早期即开始接受治疗(症状出现后 5 天内)还是晚期才开始接受治疗(症状出现后 6 至 10 天内)的患者,住院和死亡率均显著降低,这为新冠患者提供了更长的治疗窗口期。
IT之家了解到,2021 年 12 月,安巴韦单抗和罗米司韦单抗联合疗法获得国家药品监督管理局(NMPA)上市批准,用于治疗轻型和普通型且伴有进展为重型(包括住院或死亡)高风险因素的成人和青少年(12-17 岁,体重≥40 kg)新型冠状病毒感染( COVID-19)患者。其中青少年(12-17 岁,体重≥40 kg)适应症人群为附条件批准。该联合疗法于 2022 年 3 月获国家卫生健康委员会批准纳入《新型冠状病毒肺炎诊疗方案(试行第九版)》。
-
 当前报道:首个国产新冠特效药正式上市:定价1万元以内
IT之家7月9日消息,据北京日报报道,7月7日,腾盛博药及其旗下控股公司腾盛华创宣布,其新冠中和抗体安巴韦单抗和罗米司韦单抗联合疗法在中国
当前报道:首个国产新冠特效药正式上市:定价1万元以内
IT之家7月9日消息,据北京日报报道,7月7日,腾盛博药及其旗下控股公司腾盛华创宣布,其新冠中和抗体安巴韦单抗和罗米司韦单抗联合疗法在中国 -
 【全球快播报】机构:三星一季度智能手机出货量全球第,一但只有苹果实现正增长
... IT之家7月9日消息,《BanklessTimes》最近发表了一项分析报告,给出了今年第一季度各大企业之间的一些智能手机出货量数据,包括公司对不同供
【全球快播报】机构:三星一季度智能手机出货量全球第,一但只有苹果实现正增长
... IT之家7月9日消息,《BanklessTimes》最近发表了一项分析报告,给出了今年第一季度各大企业之间的一些智能手机出货量数据,包括公司对不同供 -
 今亮点!NASA 公布首批詹姆斯·韦伯望远镜全彩图,揭开宇宙最深处的奥秘
IT之家7月9日消息,NASA现公布了一张詹姆斯・韦伯太空望远镜(JWST)近期拍摄的武仙座星系照片,作为7月12日该天文台首张全彩图像的“预
今亮点!NASA 公布首批詹姆斯·韦伯望远镜全彩图,揭开宇宙最深处的奥秘
IT之家7月9日消息,NASA现公布了一张詹姆斯・韦伯太空望远镜(JWST)近期拍摄的武仙座星系照片,作为7月12日该天文台首张全彩图像的“预 -
 每日速读!马斯克表示将放弃 Twitter 收购交易
IT之家7月9日消息,据彭博社,马斯克表示他的顾问已于周五致函推特,正式通知推特他将终止收购协议,因为这家社交媒体公司已经未能提供有关虚
每日速读!马斯克表示将放弃 Twitter 收购交易
IT之家7月9日消息,据彭博社,马斯克表示他的顾问已于周五致函推特,正式通知推特他将终止收购协议,因为这家社交媒体公司已经未能提供有关虚 -
 每日热门:微软确认正在“追查”Win11 23H2 中的一个 Bug,本周不推Dev更新
IT之家7月9日消息,微软高级项目经理布兰登・勒布朗已经确认,今天不会更新Windows内部预览版,因为该公司正在忙着“追查”即将到来的DevC
每日热门:微软确认正在“追查”Win11 23H2 中的一个 Bug,本周不推Dev更新
IT之家7月9日消息,微软高级项目经理布兰登・勒布朗已经确认,今天不会更新Windows内部预览版,因为该公司正在忙着“追查”即将到来的DevC -
 每日短讯:宏碁 2022 年第二季合并营收新台币 723.48 亿元,同比减少 9.3%
IT之家7月8日消息,据宏碁官方消息,宏碁公司公布2022年6月份单月合并营收达309 45亿元新台币(约69 94亿元人民币),创八年
每日短讯:宏碁 2022 年第二季合并营收新台币 723.48 亿元,同比减少 9.3%
IT之家7月8日消息,据宏碁官方消息,宏碁公司公布2022年6月份单月合并营收达309 45亿元新台币(约69 94亿元人民币),创八年
-
 当前报道:首个国产新冠特效药正式上市:定价1万元以内
IT之家7月9日消息,据北京日报报道,7月7日,腾盛博药及其旗下控股公司腾盛华创宣布,其新冠中和抗体安巴韦单抗和罗米司韦单抗联合疗法在中国
当前报道:首个国产新冠特效药正式上市:定价1万元以内
IT之家7月9日消息,据北京日报报道,7月7日,腾盛博药及其旗下控股公司腾盛华创宣布,其新冠中和抗体安巴韦单抗和罗米司韦单抗联合疗法在中国 -
 每日信息:湖北已排查录入自建房1068万余栋 湖北日报讯(记者李朝霞、通讯员唐萍)自建房建设事关人民群众生命财产安全。7月8日,全省自建房安全专项整治工作推进视频会议上传出消...
每日信息:湖北已排查录入自建房1068万余栋 湖北日报讯(记者李朝霞、通讯员唐萍)自建房建设事关人民群众生命财产安全。7月8日,全省自建房安全专项整治工作推进视频会议上传出消... -
 每日速讯:守住蓝天白云“好气质”湖北启动臭氧防治“攻坚战” 湖北日报全媒记者胡弦通讯员喻妙章单伟明明蓝天白云,却“气质”不佳,背后基本是臭氧污染在“捣乱”。夏季治臭氧,冬季治细颗粒物(PM2...
每日速讯:守住蓝天白云“好气质”湖北启动臭氧防治“攻坚战” 湖北日报全媒记者胡弦通讯员喻妙章单伟明明蓝天白云,却“气质”不佳,背后基本是臭氧污染在“捣乱”。夏季治臭氧,冬季治细颗粒物(PM2... -
 全球今头条!地大研发月壤测量技术,多元信息测量取样仅需30微克 湖北日报讯(记者张歆、通讯员王俊芳)7月8日,记者从中国地质大学(武汉)获悉,该校佘振兵、汪在聪教授科研团队在月壤研究中取得了新...
全球今头条!地大研发月壤测量技术,多元信息测量取样仅需30微克 湖北日报讯(记者张歆、通讯员王俊芳)7月8日,记者从中国地质大学(武汉)获悉,该校佘振兵、汪在聪教授科研团队在月壤研究中取得了新... -
 环球信息:湖北7日出梅进入盛夏 预计7至8月高温少雨,气象部门:谨防阶段性高温干旱 湖北日报讯(记者曾莉、通讯员付郁)7月7日起,副热带高压加强并逐步控制湖北,湖北梅雨结束进入盛夏,出梅较常年(7月11日)偏早。今年...
环球信息:湖北7日出梅进入盛夏 预计7至8月高温少雨,气象部门:谨防阶段性高温干旱 湖北日报讯(记者曾莉、通讯员付郁)7月7日起,副热带高压加强并逐步控制湖北,湖北梅雨结束进入盛夏,出梅较常年(7月11日)偏早。今年... -
 资讯:住房和城乡建设部:初判存在安全隐患的经营性自建房26.1万栋 新华社北京7月8日电(记者王优玲)记者8日从住房和城乡建设部了解到,截至目前,全国共排查经营性自建房726万栋,初判存在安全隐患的26 1万栋
资讯:住房和城乡建设部:初判存在安全隐患的经营性自建房26.1万栋 新华社北京7月8日电(记者王优玲)记者8日从住房和城乡建设部了解到,截至目前,全国共排查经营性自建房726万栋,初判存在安全隐患的26 1万栋 -
 环球今亮点!神奇的北纬39°|歇马杏熟了!大连400年古村火了 七月,正值被誉为“杏中之王”的歇马杏成熟之时,通往大连庄河市太平岭满族乡歇马村的道路顿时热闹起来。村民们一早就把成熟的歇马杏摘...
环球今亮点!神奇的北纬39°|歇马杏熟了!大连400年古村火了 七月,正值被誉为“杏中之王”的歇马杏成熟之时,通往大连庄河市太平岭满族乡歇马村的道路顿时热闹起来。村民们一早就把成熟的歇马杏摘... -
 【全球快播报】机构:三星一季度智能手机出货量全球第,一但只有苹果实现正增长
... IT之家7月9日消息,《BanklessTimes》最近发表了一项分析报告,给出了今年第一季度各大企业之间的一些智能手机出货量数据,包括公司对不同供
【全球快播报】机构:三星一季度智能手机出货量全球第,一但只有苹果实现正增长
... IT之家7月9日消息,《BanklessTimes》最近发表了一项分析报告,给出了今年第一季度各大企业之间的一些智能手机出货量数据,包括公司对不同供 -
 今亮点!NASA 公布首批詹姆斯·韦伯望远镜全彩图,揭开宇宙最深处的奥秘
IT之家7月9日消息,NASA现公布了一张詹姆斯・韦伯太空望远镜(JWST)近期拍摄的武仙座星系照片,作为7月12日该天文台首张全彩图像的“预
今亮点!NASA 公布首批詹姆斯·韦伯望远镜全彩图,揭开宇宙最深处的奥秘
IT之家7月9日消息,NASA现公布了一张詹姆斯・韦伯太空望远镜(JWST)近期拍摄的武仙座星系照片,作为7月12日该天文台首张全彩图像的“预 -
 焦点热门:美丽浙江建设“成绩单”出炉! 7月8日,记者从浙江省建设新时代美丽浙江推进大会暨生物多样性保护大会上获悉,湖州市、金华市、衢州市等3个设区市,宁波市北仑区、温州...
焦点热门:美丽浙江建设“成绩单”出炉! 7月8日,记者从浙江省建设新时代美丽浙江推进大会暨生物多样性保护大会上获悉,湖州市、金华市、衢州市等3个设区市,宁波市北仑区、温州... -
 世界资讯:暑假来了|列车乘警提醒注意清点行李,以防漏拿错拿 随着暑期到来,出行旅客人数明显增多,时常会出现行李错拿、丢失的现象。连日来,湖南长沙铁路公安处乘警支队三大队就接连接到多起旅客...
世界资讯:暑假来了|列车乘警提醒注意清点行李,以防漏拿错拿 随着暑期到来,出行旅客人数明显增多,时常会出现行李错拿、丢失的现象。连日来,湖南长沙铁路公安处乘警支队三大队就接连接到多起旅客... -
 【全球速看料】北京7月8日新增3例本土确诊病例 据北京市卫健委通报,7月8日0时至24时,北京新增3例本土确诊病例(均为隔离观察人员),无新增疑似病例和无症状感染者;无新增境外输入确诊病
【全球速看料】北京7月8日新增3例本土确诊病例 据北京市卫健委通报,7月8日0时至24时,北京新增3例本土确诊病例(均为隔离观察人员),无新增疑似病例和无症状感染者;无新增境外输入确诊病 -
 环球观速讯丨溺水如何预防和自救?这份防溺水必备指南,请收好! 暑期来临,天气炎热溺水事故又进入高发期安全问题不容忽视如何避免悲剧发生?溺水了如何预防和自救?这份防溺水必备指南,请收好!制作...
环球观速讯丨溺水如何预防和自救?这份防溺水必备指南,请收好! 暑期来临,天气炎热溺水事故又进入高发期安全问题不容忽视如何避免悲剧发生?溺水了如何预防和自救?这份防溺水必备指南,请收好!制作... -
 每日速读!马斯克表示将放弃 Twitter 收购交易
IT之家7月9日消息,据彭博社,马斯克表示他的顾问已于周五致函推特,正式通知推特他将终止收购协议,因为这家社交媒体公司已经未能提供有关虚
每日速读!马斯克表示将放弃 Twitter 收购交易
IT之家7月9日消息,据彭博社,马斯克表示他的顾问已于周五致函推特,正式通知推特他将终止收购协议,因为这家社交媒体公司已经未能提供有关虚 -
 环球热讯:【科普中国】暑假防溺水“六不”,一定要记牢! 暑假来临,气温一路飙升。游泳是很多人喜爱的降温或消暑方式,然而每年的夏季也成了溺水事故高发期。学生溺水事故频发,令人十分痛心。...
环球热讯:【科普中国】暑假防溺水“六不”,一定要记牢! 暑假来临,气温一路飙升。游泳是很多人喜爱的降温或消暑方式,然而每年的夏季也成了溺水事故高发期。学生溺水事故频发,令人十分痛心。... -
 每日热门:微软确认正在“追查”Win11 23H2 中的一个 Bug,本周不推Dev更新
IT之家7月9日消息,微软高级项目经理布兰登・勒布朗已经确认,今天不会更新Windows内部预览版,因为该公司正在忙着“追查”即将到来的DevC
每日热门:微软确认正在“追查”Win11 23H2 中的一个 Bug,本周不推Dev更新
IT之家7月9日消息,微软高级项目经理布兰登・勒布朗已经确认,今天不会更新Windows内部预览版,因为该公司正在忙着“追查”即将到来的DevC -
 天天速读:【航拍赣鄱】千亩菱角迎丰收 晨曦农户采摘忙 (记者邓玉玲)2022年7月8日清晨,江西省新余市分宜县凤阳镇沔村菱角种植基地,菱角专业合作社组织农户采收今年首批菱角。菱角种植迎来丰收采
天天速读:【航拍赣鄱】千亩菱角迎丰收 晨曦农户采摘忙 (记者邓玉玲)2022年7月8日清晨,江西省新余市分宜县凤阳镇沔村菱角种植基地,菱角专业合作社组织农户采收今年首批菱角。菱角种植迎来丰收采 -
 当前动态:【航拍赣鄱】“渔光互补”绘就乡村振兴新图景 央广网抚州7月9日消息(见习记者盛杨泳)近日,在江西省抚州市东乡区虎圩乡陈塘村水库里,一排排光伏发电板架设其中内,与田野相互映衬...
当前动态:【航拍赣鄱】“渔光互补”绘就乡村振兴新图景 央广网抚州7月9日消息(见习记者盛杨泳)近日,在江西省抚州市东乡区虎圩乡陈塘村水库里,一排排光伏发电板架设其中内,与田野相互映衬... -
 每日短讯:宏碁 2022 年第二季合并营收新台币 723.48 亿元,同比减少 9.3%
IT之家7月8日消息,据宏碁官方消息,宏碁公司公布2022年6月份单月合并营收达309 45亿元新台币(约69 94亿元人民币),创八年
每日短讯:宏碁 2022 年第二季合并营收新台币 723.48 亿元,同比减少 9.3%
IT之家7月8日消息,据宏碁官方消息,宏碁公司公布2022年6月份单月合并营收达309 45亿元新台币(约69 94亿元人民币),创八年 -
 环球热议:三星将与微软谷歌合作,防止 Galaxy 手机被黑客攻击
IT之家7月8日消息,据SamMobile报道,三星正在努力提高其Galaxy设备对黑客网络攻击的防御能力,为此,该公司已经与微软、谷歌达成合作
环球热议:三星将与微软谷歌合作,防止 Galaxy 手机被黑客攻击
IT之家7月8日消息,据SamMobile报道,三星正在努力提高其Galaxy设备对黑客网络攻击的防御能力,为此,该公司已经与微软、谷歌达成合作 -
 【世界时快讯】转向助力或会失效!东风本田召回超3万辆汽车 转向助力或会失效!东风本田召回超3万辆汽车
【世界时快讯】转向助力或会失效!东风本田召回超3万辆汽车 转向助力或会失效!东风本田召回超3万辆汽车 -
 环球播报:货拉拉、满帮、快狗打车、滴滴货运被交通运输部约谈
IT之家7月8日消息,据交通运输部消息,2022年7月8日下午,交通运输部以交通运输新业态协同监管部际联席会议名义对货拉拉、满帮、快狗打车、滴
环球播报:货拉拉、满帮、快狗打车、滴滴货运被交通运输部约谈
IT之家7月8日消息,据交通运输部消息,2022年7月8日下午,交通运输部以交通运输新业态协同监管部际联席会议名义对货拉拉、满帮、快狗打车、滴 -
 快资讯:特斯拉2018年Model S致命车祸受害者父亲:马斯克承认错误取消限速 特斯拉2018年ModelS致命车祸受害者父亲:马斯克承认错误取消限速
快资讯:特斯拉2018年Model S致命车祸受害者父亲:马斯克承认错误取消限速 特斯拉2018年ModelS致命车祸受害者父亲:马斯克承认错误取消限速 -
 全球今亮点!一夜回到30年前 6月俄罗斯汽车销量暴跌80% 一夜回到30年前6月俄罗斯汽车销量暴跌80%
全球今亮点!一夜回到30年前 6月俄罗斯汽车销量暴跌80% 一夜回到30年前6月俄罗斯汽车销量暴跌80% -
 微速讯:配V6发动机 新款上汽大众途昂X官图发布:前后Logo都能发光 配V6发动机新款上汽大众途昂X官图发布:前后Logo都能发光
微速讯:配V6发动机 新款上汽大众途昂X官图发布:前后Logo都能发光 配V6发动机新款上汽大众途昂X官图发布:前后Logo都能发光 -
 即时焦点:长城汽车公布6月销量:堪堪突破10万不及奇瑞 长城汽车公布6月销量:堪堪突破10万不及奇瑞
即时焦点:长城汽车公布6月销量:堪堪突破10万不及奇瑞 长城汽车公布6月销量:堪堪突破10万不及奇瑞 -
 天天观点:聚焦六大特色产业 甘肃向“全网”推介“甘味” (记者魏怡)在第28届兰洽会举办之际,为进一步提升甘肃省网货品牌影响力,持续扩大销售规模,以“树品牌、强合作、促发展”为主题的“...
天天观点:聚焦六大特色产业 甘肃向“全网”推介“甘味” (记者魏怡)在第28届兰洽会举办之际,为进一步提升甘肃省网货品牌影响力,持续扩大销售规模,以“树品牌、强合作、促发展”为主题的“... -
 全球速递!海星再现胶州湾威胁贝类养殖 海星为何不请自来? 据中央广播电视总台中国之声《新闻超链接》报道,去年,山东青岛胶州湾海域出现大量海星——多棘海盘车,给贝类养殖造成了重大损失。日...
全球速递!海星再现胶州湾威胁贝类养殖 海星为何不请自来? 据中央广播电视总台中国之声《新闻超链接》报道,去年,山东青岛胶州湾海域出现大量海星——多棘海盘车,给贝类养殖造成了重大损失。日... -
 全球新动态:迪拜软件开发人员薪酬位列全球第三
IT之家7月8日消息,根据一份报告,迪拜科技行业的员工收入位居世界第三。咨询公司Mercer周三发布的一份报告显示,拥有至少三年经验的迪拜软件
全球新动态:迪拜软件开发人员薪酬位列全球第三
IT之家7月8日消息,根据一份报告,迪拜科技行业的员工收入位居世界第三。咨询公司Mercer周三发布的一份报告显示,拥有至少三年经验的迪拜软件 -
 全球热点评!联想拯救者 Y9000K/Y9000P 对比测试,12 代酷睿 HX 让帧数更高
IT之家7月8日消息,联想现已发布了2022年新款拯救者Y9000K、Y9000P游戏,前者搭载12代酷睿HX处理器,后者搭载12代
全球热点评!联想拯救者 Y9000K/Y9000P 对比测试,12 代酷睿 HX 让帧数更高
IT之家7月8日消息,联想现已发布了2022年新款拯救者Y9000K、Y9000P游戏,前者搭载12代酷睿HX处理器,后者搭载12代 -
 【天天聚看点】提信心添动能 浙江举办数字安防产业链专场对接活动 7月8日,以“提信心添动能争进位共发展”为主题的浙江省“十链百场万企”系列对接活动之数字安防产业链专场在杭州举行。此次专场以线下...
【天天聚看点】提信心添动能 浙江举办数字安防产业链专场对接活动 7月8日,以“提信心添动能争进位共发展”为主题的浙江省“十链百场万企”系列对接活动之数字安防产业链专场在杭州举行。此次专场以线下... -
 焦点播报:“2022焕新旅游目的地”主题论坛在海南万宁举行 7月8日,“2022焕新旅游目的地”主题论坛在海南省万宁市举行。论坛上,万宁市旅游和文化广电体育局与飞猪旅行签订战略合作协议,未来双...
焦点播报:“2022焕新旅游目的地”主题论坛在海南万宁举行 7月8日,“2022焕新旅游目的地”主题论坛在海南省万宁市举行。论坛上,万宁市旅游和文化广电体育局与飞猪旅行签订战略合作协议,未来双... -
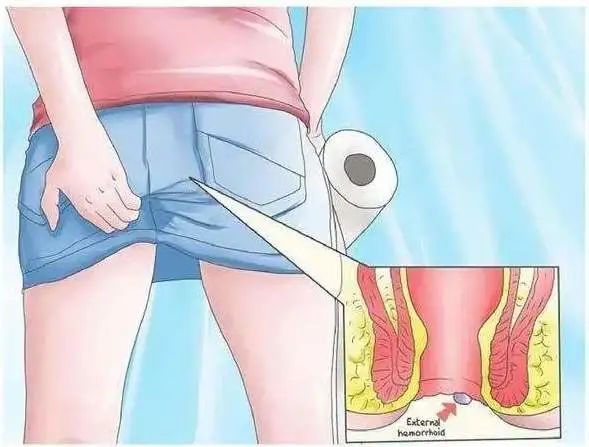 贵阳东大肛肠医院:患上痔疮久拖不治?它的危害或许被轻视! 人们常说十人九痔。其实在生活当中,痔疮是非常常见的一种疾病,但是处于私密处,所以许多朋友不好意思到医院进行就医,一拖再拖,往往会使
贵阳东大肛肠医院:患上痔疮久拖不治?它的危害或许被轻视! 人们常说十人九痔。其实在生活当中,痔疮是非常常见的一种疾病,但是处于私密处,所以许多朋友不好意思到医院进行就医,一拖再拖,往往会使 -
 大中电器41周年全民狂欢 掀消费浪潮 6月30日,大中电器中塔店大中电器41周年庆典活动圆满召开。据悉,此次活动由真快乐APP携手大中电器启动41周年庆活动,旨在真诚回馈广大消费
大中电器41周年全民狂欢 掀消费浪潮 6月30日,大中电器中塔店大中电器41周年庆典活动圆满召开。据悉,此次活动由真快乐APP携手大中电器启动41周年庆活动,旨在真诚回馈广大消费 -
 广东省钟南山医学基金会与德得租集团战略合作签约仪式圆满举行! 近日,广东省钟南山医学基金会与德得租大健康集团战略合作签约仪式在广州圆满举行。广东省钟南山医学基金会代表夏凯先生、杨思乐先生、马艳
广东省钟南山医学基金会与德得租集团战略合作签约仪式圆满举行! 近日,广东省钟南山医学基金会与德得租大健康集团战略合作签约仪式在广州圆满举行。广东省钟南山医学基金会代表夏凯先生、杨思乐先生、马艳 -
 爱肝一生·慢乙肝临床治愈珠峰工程暨重症肝病救助公益行动正式启动! 7·28世界肝炎日即将来临之际,爱肝一生·慢乙肝临床治愈珠峰工程暨重症肝病救助公益行动于四川中医肝病医院正式启动,活动气氛热烈,现...
爱肝一生·慢乙肝临床治愈珠峰工程暨重症肝病救助公益行动正式启动! 7·28世界肝炎日即将来临之际,爱肝一生·慢乙肝临床治愈珠峰工程暨重症肝病救助公益行动于四川中医肝病医院正式启动,活动气氛热烈,现... - 白手兴家-慈善与庆祝晚宴 (吉隆坡19日讯)第二届白手兴家-慈善与庆祝晚宴圆满举行,筵开近40席,来自印尼,泰国,新加坡与柬埔寨的贵宾不惜远赴而来,出席这场深具传承意义
-
 两个月时间 一款专利产品 白发自然转黑就是这么简单 自从有了二宝,我就一直辞职在家专心带娃。很多人以为不用上班特别舒服,其实做好一名家庭主妇并不是一件易事。相比上班时比较单一集中的工
两个月时间 一款专利产品 白发自然转黑就是这么简单 自从有了二宝,我就一直辞职在家专心带娃。很多人以为不用上班特别舒服,其实做好一名家庭主妇并不是一件易事。相比上班时比较单一集中的工 -
 国内独家、国际领先,圣博玛启动超高性能医疗器械产业化项目,创领科研产业化新时代。 2022年7月5日上午,长春超高性能医疗器械产业化项目启动仪式隆重举行。长春新区党工委副书记、长春新区管委会主任华景斌,吉林省发改委、吉林
国内独家、国际领先,圣博玛启动超高性能医疗器械产业化项目,创领科研产业化新时代。 2022年7月5日上午,长春超高性能医疗器械产业化项目启动仪式隆重举行。长春新区党工委副书记、长春新区管委会主任华景斌,吉林省发改委、吉林 - 早餐来杯维他奶 健康生活每一天 《中国居民膳食指南 2022》仍然建议我们坚持谷类为主的平衡膳食模式,每天的膳食应包括谷薯类、蔬菜水果、畜禽鱼蛋奶和豆类食物。实际上豆
-
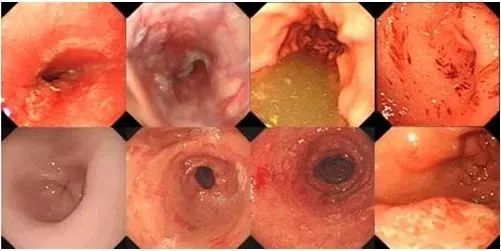 贵阳微创胃肠医院:常说胃溃疡,胃溃疡到底是什么? 胃溃疡指的是人体贲门与幽门发生的慢性溃疡称为胃溃疡,是消化性溃疡的一种。胃的内壁有一层能起到保护作用的胃黏膜,当胃黏膜由于某种原因
贵阳微创胃肠医院:常说胃溃疡,胃溃疡到底是什么? 胃溃疡指的是人体贲门与幽门发生的慢性溃疡称为胃溃疡,是消化性溃疡的一种。胃的内壁有一层能起到保护作用的胃黏膜,当胃黏膜由于某种原因 -
 头面一站式护理 尽在精致圈女性和时尚圈女性最爱的SENKEY芯涧 由于现代生活压力大,节奏快,很多人出现了掉发脱发、头发干枯、面部皮肤松弛等问题,只能靠化妆品和护发产品临时掩盖解决,费时费力不说,
头面一站式护理 尽在精致圈女性和时尚圈女性最爱的SENKEY芯涧 由于现代生活压力大,节奏快,很多人出现了掉发脱发、头发干枯、面部皮肤松弛等问题,只能靠化妆品和护发产品临时掩盖解决,费时费力不说, -
 真智能|小益携重磅新品亮相第24届中国建博会! 今日,第24届中国建博会在广州琶洲广交会展馆正式拉开序幕。中国建博会作为行业年度盛事,每年都会吸引国际国内各大一线品牌前往参展,在这
真智能|小益携重磅新品亮相第24届中国建博会! 今日,第24届中国建博会在广州琶洲广交会展馆正式拉开序幕。中国建博会作为行业年度盛事,每年都会吸引国际国内各大一线品牌前往参展,在这 - MCE展落下帷幕,热立方R290环保冷媒热泵备受瞩目! 7月1日,2022意大利米兰暖通制冷及智能家居及卫浴展览会(MCE),在意大利新米兰会展馆落下帷幕。本届MCE展是疫情之后热泵行业首个国际展会,作
-
 风筝起源于哪个国家 最初的风筝是做什么用途的 风筝运用了什么原理? 风筝的起源和它的最初的用途是什么 风筝的起源和它的最初的用途有哪些1、风筝的起源:风筝为中国人发明,相传墨翟以木头制成木鸟,研制三
风筝起源于哪个国家 最初的风筝是做什么用途的 风筝运用了什么原理? 风筝的起源和它的最初的用途是什么 风筝的起源和它的最初的用途有哪些1、风筝的起源:风筝为中国人发明,相传墨翟以木头制成木鸟,研制三 -
 顺义有什么好玩的景点 顺义自驾游哪里好玩?顺义自驾游免费景点大全 顺义有什么好玩的景点 顺义旅游景点推荐1、北京奥林匹克水上公园(Olympic Rowing-Canoeing Park),又名顺义水上公园,位于北京顺义区马
顺义有什么好玩的景点 顺义自驾游哪里好玩?顺义自驾游免费景点大全 顺义有什么好玩的景点 顺义旅游景点推荐1、北京奥林匹克水上公园(Olympic Rowing-Canoeing Park),又名顺义水上公园,位于北京顺义区马 -
 聚力闯天下,修芙俪集团万人特训营解锁新势能 深耕行业12年,无论是在功效护肤领域还是修护领域,修芙俪集团如今早已声名远播,作为以科技研发为核心抓手的美肤品牌,修芙俪集团包含了院
聚力闯天下,修芙俪集团万人特训营解锁新势能 深耕行业12年,无论是在功效护肤领域还是修护领域,修芙俪集团如今早已声名远播,作为以科技研发为核心抓手的美肤品牌,修芙俪集团包含了院 -
 劳保力量凝心守护:全民健康,一个都不能少! 8年前,一批关爱全民健康的组织和平台联合发起了一个公益节日,倡导全民健康,快乐为本的公众健康日由此诞生,在每年的7月7日都提醒我们珍视健
劳保力量凝心守护:全民健康,一个都不能少! 8年前,一批关爱全民健康的组织和平台联合发起了一个公益节日,倡导全民健康,快乐为本的公众健康日由此诞生,在每年的7月7日都提醒我们珍视健 -
 长吉体诗歌开创者是谁 腹有诗书气自华是谁的诗? 长吉体诗歌开创者是谁? 开创长吉体诗歌的是李贺吗1 开创长吉体诗歌的是李贺,字长吉2 他生于河南省富昌县长固乡(今河南省益阳县),祖
长吉体诗歌开创者是谁 腹有诗书气自华是谁的诗? 长吉体诗歌开创者是谁? 开创长吉体诗歌的是李贺吗1 开创长吉体诗歌的是李贺,字长吉2 他生于河南省富昌县长固乡(今河南省益阳县),祖 -
 囤货不可能,认准修芙俪集团5G商城清货好平台 清库存怎么清?手里产品一大堆,卖不掉可以处理吗?随着互电子商务的普及,还有近年直播电商的发展,越来越多企业或商家加入到这个行列。但
囤货不可能,认准修芙俪集团5G商城清货好平台 清库存怎么清?手里产品一大堆,卖不掉可以处理吗?随着互电子商务的普及,还有近年直播电商的发展,越来越多企业或商家加入到这个行列。但
热门资讯
-
 贵阳东大肛肠医院:患上痔疮久拖不治?它的危害或许被轻视! 人们常说十人九痔。其实在生活当中...
贵阳东大肛肠医院:患上痔疮久拖不治?它的危害或许被轻视! 人们常说十人九痔。其实在生活当中... -
 爱肝一生·慢乙肝临床治愈珠峰工程暨重症肝病救助公益行动正式启动! 7·28世界肝炎日即将来临之际,爱...
爱肝一生·慢乙肝临床治愈珠峰工程暨重症肝病救助公益行动正式启动! 7·28世界肝炎日即将来临之际,爱... -
 贵阳微创胃肠医院:常说胃溃疡,胃溃疡到底是什么? 胃溃疡指的是人体贲门与幽门发生的...
贵阳微创胃肠医院:常说胃溃疡,胃溃疡到底是什么? 胃溃疡指的是人体贲门与幽门发生的... -
 颜层®水晶针让肌肤喝饱水,清爽一整夏 炎炎夏日,烈日当头。肌肤经过夏天...
颜层®水晶针让肌肤喝饱水,清爽一整夏 炎炎夏日,烈日当头。肌肤经过夏天...
观察
图片新闻
-
 郴州:政策帮扶“及时雨”留抵退税惠及2078家纳税企业 前言:当前,世界局势复杂震荡、防...
郴州:政策帮扶“及时雨”留抵退税惠及2078家纳税企业 前言:当前,世界局势复杂震荡、防... -
 常德交警部门多措并举掀起电动车上牌热潮 共办理电动车上牌5684台 今年6月,常德公安交警部门多措并...
常德交警部门多措并举掀起电动车上牌热潮 共办理电动车上牌5684台 今年6月,常德公安交警部门多措并... -
 大运河文化溢出效应初现 多品类产品辐射不同人群 7月2日,北京市委书记蔡奇到城市副...
大运河文化溢出效应初现 多品类产品辐射不同人群 7月2日,北京市委书记蔡奇到城市副... -
 星纪时代收购魅族科技79.09%控股权 仍将独立品牌运营 7月4日,湖北星纪时代科技有限公司...
星纪时代收购魅族科技79.09%控股权 仍将独立品牌运营 7月4日,湖北星纪时代科技有限公司...
精彩新闻
-
 颜层®水晶针让肌肤喝饱水,清爽一整夏 炎炎夏日,烈日当头。肌肤经过夏天...
颜层®水晶针让肌肤喝饱水,清爽一整夏 炎炎夏日,烈日当头。肌肤经过夏天... - 吃好不等于吃健康 维他奶建议 营养科普很重要 2016年全球疾病负担研究结果显示,...
-
 「华丽智库」论坛实录:在中国,奢侈品牌的可持续发展意味着哪些机遇?四位嘉宾如是说 6月30日,由华丽志旗下时尚产业研...
「华丽智库」论坛实录:在中国,奢侈品牌的可持续发展意味着哪些机遇?四位嘉宾如是说 6月30日,由华丽志旗下时尚产业研... -
 QUANTIC美国昆藤商学院 | 聘用MBA高管,有助企业营造理想的工作氛围? 同样身在职场,有人在工作时间能感...
QUANTIC美国昆藤商学院 | 聘用MBA高管,有助企业营造理想的工作氛围? 同样身在职场,有人在工作时间能感... -
 别被肌肤的“假象”所迷惑,法国宝弘给足大家“安全感” 很多人士在护肤上都会产生错觉,比...
别被肌肤的“假象”所迷惑,法国宝弘给足大家“安全感” 很多人士在护肤上都会产生错觉,比... -
 江苏景沣文旅|黄西囧小蜂时光小院打造的联谊拓展活动圆满结束! 忘记都市的快节奏,走进田园风的世...
江苏景沣文旅|黄西囧小蜂时光小院打造的联谊拓展活动圆满结束! 忘记都市的快节奏,走进田园风的世... -
 驾乘险和座位险区别 驾乘险有必要买吗 买了驾乘险还需要买座位险吗? 很多车主在给汽车买了交强险后,还...
驾乘险和座位险区别 驾乘险有必要买吗 买了驾乘险还需要买座位险吗? 很多车主在给汽车买了交强险后,还... -
 申领社保卡需要准备什么 怎么申请社保卡 实体社保卡申领流程? 如今社保卡的申请和办理已经非常方...
申领社保卡需要准备什么 怎么申请社保卡 实体社保卡申领流程? 如今社保卡的申请和办理已经非常方... -
 淡雪草莓价格多少钱一斤 淡雪草莓和普通草莓有啥区别? 淡雪草莓是很受欢迎的草莓品种,淡...
淡雪草莓价格多少钱一斤 淡雪草莓和普通草莓有啥区别? 淡雪草莓是很受欢迎的草莓品种,淡... -
 苹果手机怎么样查看激活日期 苹果官换机与新机有什么区别? 苹果手机怎么看激活日期 苹果的激...
苹果手机怎么样查看激活日期 苹果官换机与新机有什么区别? 苹果手机怎么看激活日期 苹果的激... -
 只知道微信昵称怎么找到对方 怎么恢复微信删除的好友? 只知道微信昵称怎么找到对方 微信...
只知道微信昵称怎么找到对方 怎么恢复微信删除的好友? 只知道微信昵称怎么找到对方 微信... -
 骁龙660处理器怎么样 骁龙660是什么水平 骁龙660处理器是什么档次? 骁龙660处理器怎么样 骁龙660处理...
骁龙660处理器怎么样 骁龙660是什么水平 骁龙660处理器是什么档次? 骁龙660处理器怎么样 骁龙660处理... -
 “自然健康,我们的新时尚”健合Swisse斯维诗全国巡演已开启 近日,健合集团旗下源自海外的自然...
“自然健康,我们的新时尚”健合Swisse斯维诗全国巡演已开启 近日,健合集团旗下源自海外的自然... -
 世界有几大洲几大洋 亚洲有多少个国家 欧洲有多少个国家? 世界有几大洲几大洋地球包括陆地和...
世界有几大洲几大洋 亚洲有多少个国家 欧洲有多少个国家? 世界有几大洲几大洋地球包括陆地和... -
 纳木错最佳旅游时间 纳木错一日游多少钱?纳木错一日游攻略 纳木错最佳旅游时间(几月份去纳木...
纳木错最佳旅游时间 纳木错一日游多少钱?纳木错一日游攻略 纳木错最佳旅游时间(几月份去纳木... -
 闽江学院服装与艺术工程学院服装设计作品亮相2022中国国际大学生时装周 2022年7月5日17:00,闽江学院服装与...
闽江学院服装与艺术工程学院服装设计作品亮相2022中国国际大学生时装周 2022年7月5日17:00,闽江学院服装与... -
 中岳嵩山位于哪个省什么县 中岳嵩山多少米 五岳是指哪五座山? 中岳嵩山位于哪个省什么县 中岳嵩...
中岳嵩山位于哪个省什么县 中岳嵩山多少米 五岳是指哪五座山? 中岳嵩山位于哪个省什么县 中岳嵩... - 卡萨帝冰箱西安设宴!验证细胞级保鲜实力 相比现代,古代人想吃个新鲜荔枝有...
-
 在平台活动中爆发,品牌借势抖音电商营销IP找到增长“第二曲线” 过去一年,77%的消费者从抖音认识新...
在平台活动中爆发,品牌借势抖音电商营销IP找到增长“第二曲线” 过去一年,77%的消费者从抖音认识新... -
 3年0息+购置税减半,瑞虎7 PLUS贵妃黄限定版正式到店,请速抢购 每次相遇,都是久别重逢。正如同年...
3年0息+购置税减半,瑞虎7 PLUS贵妃黄限定版正式到店,请速抢购 每次相遇,都是久别重逢。正如同年... -
 新增“四上”企业209家!岳阳超额完成上半年计划 7月4日,市统计局公布数据显示,1...
新增“四上”企业209家!岳阳超额完成上半年计划 7月4日,市统计局公布数据显示,1... -
 “氢”城相连:北京上演“集群式绿色工业革命” 2050年,北京要比全国提前10年实现...
“氢”城相连:北京上演“集群式绿色工业革命” 2050年,北京要比全国提前10年实现... -
 铁东区启动“一核三圈”基层治理体系建设福利包发放活动 6日记者获悉,铁东区工商联、党群...
铁东区启动“一核三圈”基层治理体系建设福利包发放活动 6日记者获悉,铁东区工商联、党群... -
 我市旅行社国内长线游报名量显著提升 旅游市场热度逐步提升 5日,记者从我市部分旅行社了解到...
我市旅行社国内长线游报名量显著提升 旅游市场热度逐步提升 5日,记者从我市部分旅行社了解到... -
 助力乡村振兴 农行鞍山台安支行投放农户贷款1.38亿元 近日,农行鞍山台安支行在台安县新...
助力乡村振兴 农行鞍山台安支行投放农户贷款1.38亿元 近日,农行鞍山台安支行在台安县新... -
 椰子味饮品成夏日“顶流” 椰子口味产品销售拥有更高热度 生椰拿铁、西瓜椰椰、满杯椰椰饮、...
椰子味饮品成夏日“顶流” 椰子口味产品销售拥有更高热度 生椰拿铁、西瓜椰椰、满杯椰椰饮、... -
 稳定能繁母猪存栏量!鞍山出台生猪产能调控方案 日前,市农业农村局建立以稳定能繁...
稳定能繁母猪存栏量!鞍山出台生猪产能调控方案 日前,市农业农村局建立以稳定能繁... -
 推荐:郑明明润妍抗皱套组强化肌肤屏障,抵御外界刺激 时间消逝,脸上的皱纹愈渐增多,除...
推荐:郑明明润妍抗皱套组强化肌肤屏障,抵御外界刺激 时间消逝,脸上的皱纹愈渐增多,除... -
 社保卡消磁了怎么办 社保卡消磁去银行还是社保局办理? 对于大多数的人来说都是有购买社保...
社保卡消磁了怎么办 社保卡消磁去银行还是社保局办理? 对于大多数的人来说都是有购买社保... -
 社保卡可以在手机上激活吗 手机上怎样查询社保卡有没有激活? 社保卡现在基本上是每人都有,而且...
社保卡可以在手机上激活吗 手机上怎样查询社保卡有没有激活? 社保卡现在基本上是每人都有,而且... -
 凯叔讲故事联合聚合文娱,独创院线级沉浸式娱乐空间,领跑全国 近年来,剧本体验类社交玩法愈渐风...
凯叔讲故事联合聚合文娱,独创院线级沉浸式娱乐空间,领跑全国 近年来,剧本体验类社交玩法愈渐风... -
 全球聚焦:背刺比亚迪+长城 吉利新能源皮卡品牌定名“雷达” 背刺比亚迪+长城吉利新能源皮卡品...
全球聚焦:背刺比亚迪+长城 吉利新能源皮卡品牌定名“雷达” 背刺比亚迪+长城吉利新能源皮卡品... -
 全球通讯!三星 Galaxy Buds 2 Pro 360 度渲染图曝光
IT之家7月8日消息,三星GalaxyBuds...
全球通讯!三星 Galaxy Buds 2 Pro 360 度渲染图曝光
IT之家7月8日消息,三星GalaxyBuds... -
 天天微动态丨realme真我GT2大师探索版预热:195g机身塞入5000mAh大电池
IT之家7月8日消息,realme真我GT2...
天天微动态丨realme真我GT2大师探索版预热:195g机身塞入5000mAh大电池
IT之家7月8日消息,realme真我GT2... -
 【天天播资讯】家人把孩子忘车内互相推卸责任 孩子被忘车中会怎样? 近日家人把孩子忘车内互相推卸责任...
【天天播资讯】家人把孩子忘车内互相推卸责任 孩子被忘车中会怎样? 近日家人把孩子忘车内互相推卸责任... -
 焦点热门:大熊猫狗刨式冲浪上热搜 戏称“国家级冲浪选手” 近日大熊猫河里冲浪上演国宝式狗刨...
焦点热门:大熊猫狗刨式冲浪上热搜 戏称“国家级冲浪选手” 近日大熊猫河里冲浪上演国宝式狗刨... -
 世界快报:倩女幽魂哪个职业好?倩女幽魂手游pve怎么玩? 倩女幽魂哪个职业好(倩女幽魂手游p...
世界快报:倩女幽魂哪个职业好?倩女幽魂手游pve怎么玩? 倩女幽魂哪个职业好(倩女幽魂手游p... -
 当前动态:有哪些好网站分享? 有什么好看的网站(谁给个网站啊急...
当前动态:有哪些好网站分享? 有什么好看的网站(谁给个网站啊急... -
 天天观焦点:7月7日陕西新增1例本土确诊病例 8例无症状感染者 央广网西安7月8日消息(见习记者王...
天天观焦点:7月7日陕西新增1例本土确诊病例 8例无症状感染者 央广网西安7月8日消息(见习记者王... -
 【独家】理想中枪!媒体评“500万内最好家用SUV”营销 涉嫌违反广告法 理想中枪!媒体评“500万内最好家...
【独家】理想中枪!媒体评“500万内最好家用SUV”营销 涉嫌违反广告法 理想中枪!媒体评“500万内最好家... -
 当前热门:郑州夏季招聘夜市来了 中工网讯据河南工人日报消息,美食...
当前热门:郑州夏季招聘夜市来了 中工网讯据河南工人日报消息,美食... -
 每日报道:一本万利植物是什么?哪些植物需多加修剪才能妥善生长? 一本万利植物(一本万利植物图片)...
每日报道:一本万利植物是什么?哪些植物需多加修剪才能妥善生长? 一本万利植物(一本万利植物图片)... -
 滚动:SpaceX 再次成功发射 53 颗星链组网卫星,卫星总数已达 2759 颗
IT之家7月8日消息,北京时间昨晚,...
滚动:SpaceX 再次成功发射 53 颗星链组网卫星,卫星总数已达 2759 颗
IT之家7月8日消息,北京时间昨晚,... -
 每日讯息!云南千亩竹林遭竹蝗啃食 云南昆明哪里有竹林? 云南千亩竹林遭竹蝗啃食(云南昆明...
每日讯息!云南千亩竹林遭竹蝗啃食 云南昆明哪里有竹林? 云南千亩竹林遭竹蝗啃食(云南昆明... -
 术后患者告诉你 为什么ONSTIN人参皂苷胶囊值得买 如果真有得选的话,谁也不愿意感染...
术后患者告诉你 为什么ONSTIN人参皂苷胶囊值得买 如果真有得选的话,谁也不愿意感染... -
 世界快讯:为什么弹幕说郭麒麟是郭德纲儿子?这话什么意思? 为什么弹幕说郭麒麟是郭德纲儿子(...
世界快讯:为什么弹幕说郭麒麟是郭德纲儿子?这话什么意思? 为什么弹幕说郭麒麟是郭德纲儿子(... -
 热点评!00后就业“拥抱变化”远胜“抱残守缺” 又是毕业季,首批00后告别校园,步...
热点评!00后就业“拥抱变化”远胜“抱残守缺” 又是毕业季,首批00后告别校园,步... -
 世界观天下!夏日美景|雨后,当古建遇上晚霞 当古建遇上晚霞,会是怎样的意境?...
世界观天下!夏日美景|雨后,当古建遇上晚霞 当古建遇上晚霞,会是怎样的意境?... -
 【环球报资讯】植物神调胶囊有什么功效?植物神经紊乱中医叫湿气重吗? 植物神调胶囊(植物神经紊乱中医叫...
【环球报资讯】植物神调胶囊有什么功效?植物神经紊乱中医叫湿气重吗? 植物神调胶囊(植物神经紊乱中医叫... -
 焦点报道:tvb为什么排挤胡定欣?怎样才能爱上运动? 胡定欣吧(tvb为什么排挤胡定欣)...
焦点报道:tvb为什么排挤胡定欣?怎样才能爱上运动? 胡定欣吧(tvb为什么排挤胡定欣)...